چرا محلول نمک رسانای جریان الکتریکی است
نمک یکی از مواد رایج در خانههاست که معمولاً برای طعم دادن به غذا استفاده میشود. اما آیا میدانستید که وقتی نمک در آب حل میشود، میتواند برق را هدایت کند؟ این ویژگی جالب، سالهاست که توجه دانشمندان، معلمان و دانشآموزان را به خود جلب کرده است. در این مقاله جامع، به بررسی این موضوع میپردازیم که چرا محلول نمک برق را هدایت میکند، پشتوانه علمی این پدیده چیست، چه کاربردهایی دارد و مفاهیم مرتبط با آن چیست.
فهرست مطالب
- هدایت الکتریکی چیست؟
- محلول نمک چیست؟
- الکترولیتها را بشناسید
- نقش یونها در هدایت برق
- چرا آب خالص برق را خوب هدایت نمیکند
- چگونه نمک در آب حل میشود
- چرا محلول نمک برق را هدایت میکند
- عوامل مؤثر بر هدایت الکتریکی محلول نمک
- انواع نمکها و قدرت هدایت آنها
- کاربردهای واقعی محلولهای نمکی رسانا
- باورهای نادرست رایج
- جمعبندی
- سوالات متداول
1. هدایت الکتریکی چیست؟
هدایت الکتریکی به توانایی یک ماده برای عبور جریان الکتریکی گفته میشود. در فلزاتی مانند مس و آلومینیوم، این جریان توسط الکترونهای آزاد منتقل میشود. اما در مایعات، برق توسط ذرات باردار به نام یون منتقل میشود، نه الکترون.
برای اینکه یک مایع بتواند برق را هدایت کند، باید یونهای آزاد در آن حضور داشته باشند.
2. محلول نمک چیست؟
محلول نمک زمانی ایجاد میشود که نمک خوراکی (سدیم کلرید یا NaCl) یا هر نمک دیگری در آب حل شود. در این فرآیند، نمک به یونهای سازندهاش تجزیه شده و در آب پخش میشود. این یونها همانهایی هستند که باعث هدایت برق در محلول میشوند.
نمکهای رایج برای تهیه محلول رسانا:
- سدیم کلرید (NaCl)
- پتاسیم کلرید (KCl)
- منیزیم سولفات (MgSO₄)
- کلسیم کلرید (CaCl₂)
3. الکترولیتها را بشناسید
الکترولیت مادهای است که در آب حل میشود و یون تولید میکند، و به این ترتیب امکان هدایت برق را فراهم میکند. نمکها نمونهای از الکترولیتهای قوی هستند، زیرا به طور کامل در آب تفکیک میشوند.
انواع الکترولیتها:
- الکترولیت قوی: کاملاً تفکیک میشود (مثل NaCl، HCl)
- الکترولیت ضعیف: بخشی از آن یونیزه میشود (مثل اسید استیک)
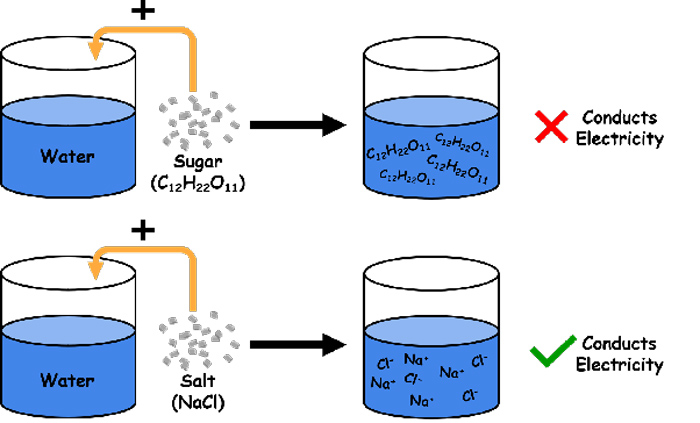
- غیر الکترولیت: اصلاً یون تولید نمیکند (مثل قند)
4. نقش یونها در هدایت برق
یونها ذرات باردار هستند که یا بار مثبت دارند (کاتیون) یا بار منفی (آنیون).
هنگامی که ولتاژ به یک محلول نمک وارد میشود:
- کاتیونها به سمت قطب منفی حرکت میکنند.
- آنیونها به سمت قطب مثبت حرکت میکنند.
این حرکت یونها باعث جریان یافتن جریان الکتریکی در محلول میشود.
5. چرا آب خالص برق را خوب هدایت نمیکند؟
برخلاف تصور رایج، آب خالص (آب مقطر) رسانای خوبی نیست. زیرا تعداد یونهای آزاد در آن بسیار کم است. یونهای موجود در آب خالص تنها به مقدار بسیار اندک از تفکیک خودآبه (H⁺ و OH⁻) میآیند که برای رسانایی کافی نیستند.
وقتی نمک به آب افزوده میشود، تعداد زیادی یون تولید میشود و هدایت برق بهطور چشمگیری افزایش مییابد.
6. چگونه نمک در آب حل میشود
زمانی که نمک در آب ریخته میشود:
- مولکولهای قطبی آب اطراف یونهای Na⁺ و Cl⁻ قرار میگیرند.
- نیروهای جاذبه بین مولکولهای آب و یونهای نمک، پیوند یونی موجود در بلور نمک را میشکنند.
- یونهای Na⁺ و Cl⁻ جدا شده و در آب پراکنده میشوند.
این فرآیند را تفکیک یونی یا یونیزاسیون مینامند. این یونهای آزاد همانهایی هستند که برق را منتقل میکنند.
7. چرا محلول نمک برق را هدایت میکند؟
دلایل اصلی هدایت الکتریکی محلول نمک عبارتند از:
- وجود یونها: نمک هنگام حل شدن، یونهای Na⁺ و Cl⁻ آزاد میکند.
- تحرک یونها: این یونها در محلول آزادانه حرکت میکنند.
- ولتاژ خارجی: وقتی برق وارد میشود، یونها به سوی الکترودها حرکت میکنند و جریان را برقرار میکنند.
خلاصه ساده: محلول نمک برق را هدایت میکند، چون یونهای آن در آب شناور هستند و میتوانند بار الکتریکی را منتقل کنند.
8. عوامل مؤثر بر هدایت الکتریکی محلول نمک
چند عامل مهم در میزان هدایت محلول نمکی نقش دارند:
1. غلظت نمک
- غلظت بیشتر = یونهای بیشتر = هدایت بهتر
- البته غلظت بیش از حد ممکن است باعث کاهش حرکت آزاد یونها شود
2. دما
- با افزایش دما، حرکت یونها سریعتر میشود
- در نتیجه هدایت معمولاً با افزایش دما بیشتر میشود
3. نوع نمک
- برخی نمکها یونهای بیشتری تولید میکنند
- مثلاً CaCl₂ سه یون تولید میکند (یک Ca²⁺ و دو Cl⁻) در حالیکه NaCl فقط دو یون تولید میکند
4. خلوص آب
- ناخالصیها ممکن است هدایت را افزایش یا کاهش دهند
- آب مقطر خالص به تنهایی رسانای ضعیفی است
9. انواع نمکها و قدرت هدایت آنها
جدولی از چند نمک رایج و قدرت رسانایی آنها:
| نمک | تجزیه یونی | تعداد یونها | رسانایی |
|---|---|---|---|
| NaCl | Na⁺ + Cl⁻ | 2 | خوب |
| CaCl₂ | Ca²⁺ + 2Cl⁻ | 3 | بهتر |
| KNO₃ | K⁺ + NO₃⁻ | 2 | خوب |
| AlCl₃ | Al³⁺ + 3Cl⁻ | 4 | بسیار خوب |
هرچه تعداد یونهای آزاد بیشتر باشد، رسانایی هم بیشتر است (در شرایط برابر).
10. کاربردهای واقعی محلولهای نمکی رسانا
1. الکترولیز
در صنعت برای استخراج فلزات و تولید گازهایی مانند کلر و هیدروژن استفاده میشود.
2. باتریها
برخی باتریها از محلول نمک به عنوان الکترولیت استفاده میکنند.
3. بدن انسان
نمک در خون و سلولها به انتقال سیگنالهای عصبی کمک میکند.
4. تصویه آب و شیرینسازی
هدایت الکتریکی معیار مهمی در سنجش کیفیت آب است.
5. کشاورزی
هدایت الکتریکی خاک (که تحت تأثیر نمک است) بر آبیاری و رشد گیاهان تأثیر دارد.
11. باورهای نادرست رایج
- «خود نمک برق را هدایت میکند.»
❌ نادرست. نمک خشک رسانا نیست؛ باید در آب حل شود تا یونها بتوانند حرکت کنند. - «همه مایعات برق را هدایت میکنند.»
❌ نادرست. فقط مایعاتی که یونهای آزاد دارند (مثل محلولهای نمکی) رسانا هستند. - «آب مقطر رساناست.»
❌ خیر. آب خالص رسانایی بسیار ضعیفی دارد مگر اینکه ناخالصی یا نمک به آن اضافه شود.
12. جمعبندی
دلیل هدایت برق در محلول نمک به شرح زیر است:
- نمک در آب به یونهای باردار تجزیه میشود.
- این یونها در محلول بهطور آزاد حرکت میکنند.
- با اعمال ولتاژ، یونها بین الکترودها حرکت کرده و جریان الکتریکی برقرار میشود.
- هرچه تعداد و تحرک یونها بیشتر باشد، هدایت بهتر خواهد بود.
درک این پدیده، ما را به فهم بهتر از اصول شیمی و فیزیک نزدیکتر میکند.
13. سوالات متداول
❓ آیا آب نمک بهتر از آب معمولی برق را هدایت میکند؟
✅ بله، چون یونهای بیشتری دارد.
❓ آیا محلول قند رسانای برق است؟
❌ خیر، قند یون تولید نمیکند.
❓ آیا میتوان از محلول نمک در باتری استفاده کرد؟
✅ بله، برخی باتریهای ساده از آن استفاده میکنند.
❓ آیا استفاده از برق در آب نمک خطرناک است؟
⚠️ بله، چون رساناست و باید ایمنی رعایت شود.
❓ پس از عبور برق، چه بلایی بر سر نمک میآید؟
اگر واکنش شیمیایی خاصی (مثل الکترولیز) اتفاق نیفتد، نمک در محلول باقی میماند.
نتیجهگیری نهایی
هدایت الکتریکی محلول نمک یک مثال عالی از تلاقی علم شیمی و فیزیک در زندگی روزمره است. درک اینکه یونها چگونه برق را منتقل میکنند، به ما کمک میکند تا مفاهیم مهمتری را نیز درک کنیم، از جمله عملکرد سلولهای عصبی، باتریها، تصفیه آب و حتی فرآیندهای صنعتی پیشرفته.